Кошурникова А. С. — врач эндоскопист ГБУЗ МО МОНИКИ,
Терещенко С. Г. — зав. эндоскопическим отделением ГБУЗ МО МОНИКИ,
Ермилова Е. А. — врач эндоскопист ГБУЗ МО МОНИКИ,
Машков А. Е. — зав. отделением детской хирургии ГБУЗ МО МОНИКИ,
Киримов Ю. Я. — врач эндоскопист ГБУЗ МО МОНИКИ
г. Москва
Цель работы.
Оценка эффективности методов лечения рубцовых сужений пищевода после химических ожогов, обусловленных различными агрессивными агентами.
Материалы и методы.
Под наблюдением находилось 58 детей с химическими ожогами верхних отделов пищеварительного тракта.
По возрасту, больные распределились следующим образом: 38 детей (65%) (28 мальчиков и 10 девочек) находились в возрастной группе от 1,1 до 3-х лет; остальная возрастная группа 16 (27%) человек, варьировала от 3,1 года до 7 лет (9 мальчиков и 7 девочек); до 14 лет — 4 (7%) ребенка (2 мальчика и 2 девочки).
По агрессивному агенту случайного приёма больные распределялись следующим образом: уксусная эссенция в концентрации от 9-70% — 35 детей (60%), щёлочь (≪крот≫, компонент батарейки) — 17 детей (30%), паяльная кислота — 2 ребёнка (3%), порошок перманганат калия — 4 ребёнка (7%).
Дети поступали в отделение детской хирургии института после окончания острого периода, большинство 55 человек (94%) от 2 — 3 недель до 2-4 лет после ожога.
Время пребывания детей в стационаре варьировало от 6 до 86 суток в зависимости от тяжести состояния.
Наиболее выраженные изменения пищевода возникали в местах физиологических сужений: в3 пищевода — 15 человек (26%); с3 — 30 человек (52,5%); н3 — 8 человек (13%); тотальное поражение пищевода — 3 человека (5,5%). Повреждение желудка в области кардии было у 2 детей (3%). Тотальное поражение было характерно при употреблении раствора средства ≪крот≫.
I стадия ожога (гиперемия и отёк слизистой оболочки) констатирована у 11 детей (17%), II стадия (некроз и изъязвление слизистой оболочки) — 30детей (57%), III стадия (образование грануляционной ткани) — 12 детей (18%), IV -рубцевание — 5 человек (8%). По числу сужений в пищеводе: единичные, множественные. По протяженности: мембранозные -до 1см, короткие (стриктуры) -до 1,5см, протяженные (стенозы) — более 1,5 см.
Больным в условиях детского хирургического стационара проводился курс эндоскопического бужирования с использованием металлической струны проводника с пружинным наконечником. Эзофагогастроскопия выполнялась эндоскопами уменьшенного диаметра:
гастроскопом, бронхоскопом. Перед бужированием выполнялась рентгенологическая диагностика пищевода и желудка, уровней поражения: верхней и нижней границ органа, диаметра сужений, их протяженности, наличия сочетанного поражения желудка, объёма супрастенотического расширения. В комплексном лечении использовались: магнитотерапия, электрофорез на грудную
клетку в проекции сужения с аминокапроновой кислотой 5%, сеансы гипербарической оксигенации, диета, медикаментозные препараты.
При наличии кольцевидных рубцовых стриктур выполнялось рассечение рубцов с последующим бужированием. При необходимости накладывалась гастростома.
Результаты
Эффективность лечения оценивалась по следующим критериям:
— устранение дисфагии за короткий промежуток времени,
— восстановление пассажа пищи естественным путём (без накладывания гастростомы),
— расслабление стенок пищевода при прохождении пищевого комка,
— достижение равномерного расширения просвета в области сужения, снижающее возможность развития псевдодивертикулов,
— предупреждение развития рубцового сужения просвета пищевода.
С учетом вышеизложенных критериев получены следующие результаты:
Бужирование рубцовых стриктур пищевода проводилось при стандартном эндоскопическом исследовании по предварительно проведённой струне стандартными бужами. Отличные результаты бужирования были получены у 35 (60,3%), хорошие — у 15 (25,8%), удовлетворительные -у 5 (8,7%), плохие -3 (5,2%) детей, последние были оперированы, им проведена резекция пищевода с его пластикой. Перфораций пищевода не было. В 1 (1,7%) случае наблюдалось умеренное кровотечение, остановленное эндоскопически. Других осложнений не было.
Стенозы в ближайшие 2 года были выявлены у 3 (5,1%) детей. Следует отметить, что поздние стенозы развились у пациентов не получавших антисекретор-__ную терапию и дополнительные консервативные методы лечения.
Выводы.
Использование специальных бужей при стандартном эндоскопическом исследовании, последующей медикаментозной терапии и физиотерапии позволяет достигнуть достаточного расширения пищевода для пассажа пищи и улучшения качества жизни.
На основании проведенного обследования можно отметить увеличение числа детей с поражениями пищевода дисковыми батарейками, что обусловлено ростом количества электронных игрушек и приборов.
риобретенное сужение пищевода у детей. Ожоги и инородные тела пищевода
Приобретенное сужение пищевода у детей. Ожоги и инородные тела пищеводаПриобретенное сужение пищевода может наступить от различных причин: химического ожога пищевода, попадания инородных тел, эзофагита, параэзофагита, в результате оперативных вмешательств. Более или менее быстро появляются в разной степени затруднения проглатывания. Рентгеноскопией взвесью бария уточняются локализация, форма и протяженность сужения, расположение отверстия прохода сужения и наличие расширения над сужением. Ценные указания дает эзофагоскопия. Химические ожоги пищевода приводят к его сужению по мере рубцевания. В острой стадии отмечаются как местные, так и общие симптомы различной тяжести, в зависимости от принятого вещества, его концентрации и количества. Развивается воспаление с гиперемией и отеком слизистой оболочки ротовой полости, зева и пищевода, появляется усиленное слюноотделение, иногда кровянистое. Дети из-за болезненности во рту, глотке и в груди избегают проглатывать даже жидкость и слюну. В тяжелых случаях интоксикация и шоковое состояние представляют угрозу для жизни. В легких случаях острые явления быстро затихают и эрозии слизистой оболочки к началу второй недели заживают без следов. При тяжелых повреждениях возникают язвы в пищеводе, которые заживают гранулированием и с развитием рубцового сужения. Отмечается период мнимого благополучия, после которого по мере рубцевания развиваются симптомы нарастающего нарушения проходимости пищевода. Затруднения проглатывания появляются в конце 2-й или на 3-й неделе после химического ожога. Обычно они увеличиваются постепенно, дети приучаются пить небольшими глотками, помогают прохождению пищи, надавливая на шею пальцами, с наклоном или поворотом головы. При глотании видно резкое напряжение глоточных мышц.
При закупорке просвета пищевода куском плотной пищи или инородным телом (косточка, семечко и т. п.) наступает полная задержка пищи и жидкости, а в результате острое обезвоживание, нарушение питания и водно-солевого обмена. Самым ценным методом диагностики является рентгенологическое исследование взвесью бария. В стадиях изъязвления и грануляций на контурах пищевода видны грубозернистые образования и ниши. В стадии рубцевания с образованием сужения о степени последнего судят по прохождению контрастной взвеси (жидкой и более густой): хорошей струей, тонкой струей, зигзагообразной, нитевидной струей, пятнами, капельками. Рентгенологически уточняются место сужения, размеры просвета, центральное или эксцентрическое расположение отверстия, протяженность сужения, «го направление, наличие расширения над сужением, его форма и размеры (карман, дивертикул). Инородные тела задерживаются в пищеводе, если они крупные или острые, обычно на уровнях физиологических сужений: в верхней части пищевода, у бифуркации трахеи и над кардией. В зависимости от места задержки инородного тела, от его особенностей ы размеров появляются расстройства глотания, кашель, одышка, цианоз. Эти нарушения чаще встречаются при задержке инородного тела на уровне перстневидного хряща. Вскоре присоединяются симптомы воспаления, иногда осложняющиеся перфорацией пищевода и медиастинитом. Неконтрастные инородные тела не дают непосредственно тень при рентгенологическом исследовании. Место локализации и характер инородного тела уточняют с помощью исследования контрастной взвесью с эзофагографией. Иногда видно «обтекание» инородного тела контрастной взвесью. Эзофагоскопия в большинстве случаев позволяет не только рассмотреть инородное тело, но и удалить его. Эзофагит может быть вызван причинами местного характера (едкие химические вещества, инородные тела, скользящая грыжа пищеводного отверстия) и редко общими заболеваниями (скарлатина, тиф, дифтерия и др.). Симптомы проявляются в виде нарушений проглатывания (дисфагия), болью за грудиной при глотании, отрыгиванием кровянистых масс. После затихания острых воспалительных явлений может наступить рубцовое сужение пищевода. Периэзофагит и параэзофагит возникают от перехода воспаления (эзофагита) на окружающие ткани средостения. Симптомы зависят от характера основного поражения. — Также рекомендуем «Дивертикулы пищевода у детей. Ахалазия и халазия пищевода» Оглавление темы «Болезни пищевода и органов грудной клетки у детей»: 1. Признаки бронхоэктатической болезни. Диагностика бронхоэктатической болезни у детей 2. Эхинококк легкого у детей. Хирургические заболевания пищевода у детей 3. Атрезия пищевода у детей. Врожденный стеноз пищевода у детей 4. Приобретенное сужение пищевода у детей. Ожоги и инородные тела пищевода 5. Дивертикулы пищевода у детей. Ахалазия и халазия пищевода 6. Диафрагмальная грыжа у детей. Формы диафрагмальных грыж 7. Симптомы диафрагмальной грыжи у детей. Рвота и геморрагический синдром при диафрагмальной грыже 8. Короткий пищевод и параэзофагеальная грыжа у детей. Релаксация диафрагмы у детей 9. Травмы грудной клетки у детей. Формы закрытой травмы грудной клетки у детей 10. Воспаление средостения у детей. Туберкулез лимфатических узлов средостения у детей |
Ожоги и рубцовые сужения пищевода у детей
1. Ожоги и рубцовые сужения пищевода у детей
2. Физиологические сужения пищевода
3. Частота химических ожогов
Возраст
Кол. пациентов
2-3 года
28
4-5 лет
11
6-10 лет
9
Данные клиники каф. детской хирургии с 2000 по 2008 гг.
4. Патогенез
5. Хим. вещества, явившиеся причиной ожога пищевода
Хим. вещество
Кол. больных
Уксусная эссенция
15
Минеральная кислота
5
Щелочесодержащие растворы
22
Марганец (кристаллический)
10
Чистящие средства и стиральные порошки
101
Чистящее средство «Крот»
24
Аккумуляторная жидкость
(щелочная,кислотная)
12
6.
7. Степени ожога
I ст — поражается только поверхностный слой
слизистой оболочки
II ст — поражается подслизистая основа и
внутренний мышечный слой
III ст — поражаются все слои стенки пищевода,
приводящие к перфорации
При I ст — эпителизация
При II-III ст развитие рубцовых стриктур
8. Факторы, определяющие степень поражения пищевода при ожоге
•Характер принятого вещества
•Количество принятого вещества
•Концентрация раствора
•Консистенция принятого вещества
•Экспозиция (время соприкосновения)
химического реагента со стенкой
пищевода
9. Патологические изменения — 4 периода
•Некроза
•Отторжения
•Грануляции
•Рубцевания
10. Морфологические стадии химических ожогов пищевода
11. Стадии химических ожогов пищевода
12. Клиника
13. Диагностика
14. Диагностика
15. Лечение
Ожог щелочью
Ожог кислотой
16. Лечение ожогов пищевода в остром периоде
17. Лечение
Антибиотикотерапия
Через рот смесь по 1 чайной ложке каждые 30-40 минут
Растительное масло 100,0 / Анестезин, Тетрациклин по
1,0 (ампициллин) или йодинол.
Через 3 суток сливки, молоко, сметану, сырые яйца.
При тяжелой степени — питание через 5-10 суток
18. Осложнения вызванные химическим ожогом пищевода
Ранние: шок, отек гортани, гемолиз, острая почечная
недостаточность
Поздние: стриктура, истощение
Легочные
Ранние: острый трахеобронхит, пневмония,
пищеводно-бронхиальный свищ
Поздние: пневмония, абсцесс легкого, бронхоэктазы,
пищеводно-бронхиальный свищ
Перфорация: медиастинит, перикардит, эмпиема плевры,
кровотечение
Прочие: инородные тела, дивертикулы, грыжа пищеводного
отверстия диафрагмы, рак пищевода, осложнения при
бужировании, анемия, сепсис
19. Рентген контрастные исследования
20.
21.
22.
23. Лечени: бужирование
Раннее бужирование через 4-5 дней
(до отхождение струпа)
Позднее (лечебное) через 2 месяца
24. Рубцовые сужения пищевода
25. Рубцовые сужения пищевода
26. Использование баллона-дилятатора
27. Использование баллона-дилятатора
28. Гастростомия по Витцелю — Юдину
29. Гастростомия по Кадеру
30. Гастростомия по Топроверу
31. Гастростомия по Depage-Janeway
32. Лечени: бужирование
Методы бужирования:
33. Ру (1906) провел эзофагопластику из тонкой кишки 11 летнему мальчику
34. П.А. Герцен
Три этапа:
•Мобилизация
тонкой кишки
•Создание
анастомоза кишки
с желудком
•Создание
анастомоза кишки
с пищеводом
35. С.С. Юдин
Усовершенствовал
создание
трансплантата
Специальный
инструмент для
канала под кожей
За 20 лет — 318
больных
с летальностью 9%
36. Гаврилиу (1957) — эзофагопластика из большой кривизны желудка
37. Келлинг (1941) — поперечно-ободочная кишка
38. Ройт (1923) — из правой половины толстой кишки и частью поперечно- ободочной кишки
39. Орсони и Тупе (1950) — из левой половины толстой кишки
40. Лафарг, Дюфур, Кабанье (1951) «Бордосский метод»
Из правой половины
толстого и терминального отдела
подвздошной кишки
Эндоскопия в лечении детей со стриктурой пищевода после химического ожога
В детской хирургии наиболее частой причиной для вмешательства на пищеводе являются послеожоговые стенозы вследствие проглатывания концентрированной щелочи или кислоты. Наряду с традиционными методами в настоящее время в лечении стеноза пищевода нашли свое приложение эндоскопические лазерные технологии, обеспечивающие хирургическое вмешательство с визуальным контролем.
Цель работы — оценить результаты эндоскопического лечения стриктур пищевода после химического ожога у детей с применением методов дилатации пищевода и лазерной реканализации.
Работа выполнена на базе УЗ «Городская клиническая больница № 1» Минска. Применена лазерная технология в лечении 21 ребенка в возрасте от 1 года до 16 лет, поступившего в клинику с химическим ожогом пищевода, полученным в быту при случайном проглатывании агрессивного химического вещества. Показанием к выполнению лазерной реканализации и абляции явилась стриктура пищевода с избыточной грануляцией и метаплазией эпителия. Использован медицинский многофункциональный лазерный комплекс MULTILINE (Беларусь), а также контактный скальпель с неодимовым излучателем с длиной волны 1024 и 1340 нм и регулируемой режущей, коагулирующей и абляционной способностью.
Все диагностические и лечебные мероприятия проводили под общим обезболиванием с интубацией трахеи и искусственной вентиляцией легких. Для оценки наличия и характера поражения стенки пищевода выполняли эзофагоскопию, используя эзофагогастродуоденоскоп с торцевой оптикой с углом поля зрения 140°. Оценивали степень сужения просвета пищевода, наличие супрастенотического расширения, состояние верхнего сегмента пищевода, протяженность стриктуры. В зависимости от результата осмотра выбирали методику лечения, последовательность манипуляций. При наличии стриктуры и отсутствии грануляций выполняли реканализацию путем нанесения двух-трех циркулярных продольных насечек по всей длине стриктуры с использованием контактного световода и лазерного излучателя с длиной волны 1024 нм. При сочетании стриктуры и грануляций вначале наносили насечки, затем меняли световод и излучатель для выполнения бесконтактной абляции грануляций. Для абляции использовали световод с торцом в виде шарика и неодимовым излучателем с длиной волны 1340 нм. Длительность экспозиции зависит от характера грануляций и площади поражения и составляет от 2 до 6 с. При каждой манипуляции обязателен контроль гемостаза, кровоточащие участки дополнительно коагулировали лазером. После завершения хирургического вмешательства проверяли проходимость пищевода и эвакуировали содержимое желудка. Повторное хирургическое вмешательство показано при появлении признаков рестенозирования: рвоты, дисфагии и др.
Наряду с лазерной реканализацией использовали пищеводный баллон-дилататор (расширитель). При неэффективности лазерной реканализации и методов механической дилатации пищевода прибегали к имплантации пищеводного стента, изготовленного из нитиноловой проволоки (ELLA-CS, Чешская Республика).
Дети поступали на лечение в плановом порядке из регионов Республики Беларусь, Украины, Российской Федерации с рубцовыми стриктурами пищевода вследствие химических ожогов слизистой оболочки рта, гортани, пищевода. В 19 случаях ожоги были вызваны средствами бытовой химии в жидком или кристаллическом виде, содержащими щелочь или кислоту, в 1 случае — кристаллами калия перманганата и в 1 — спиртовой настойкой. Лишь в 2 случаях из общего числа в лечении была использована лазерная реканализация стриктур пищевода без применения других хирургических методов. У этих детей имелись умеренные, небольшой протяженности стриктуры с просветом пищевода, достаточным для введения эндоскопа диаметром 5,8 мм. В лечении 7 детей комплекс терапии наряду с лазерной технологией включал методы дилатации стриктур пищевода с применением баллона или бужа. У 8 детей с ожогами тяжелой степени, выраженными и протяженными стриктурами пищевода, рубцовой деформацией ротоглотки, нарушениями глотания и дыхания были выполнены операции гастростомии в 7 случаях, трахеостомии в 2 (у 1 ребенка одновременно выполнены гастостомия и трахеостомия). Пищеводный стент был введен 5 детям, из которых 2 перенесли гастростомию. Отсутствие эффекта проводимой терапии у 4 детей послужило основанием для реконструктивных хирургических вмешательств с наложением эзофагоколоноанастомоза.
Приводим клинический пример, на опубликование которого получено письменное согласие родителей ребенка.
Ребенок Д., рожденный в первых родах, в физиологический срок, массой тела 3230 г. Развивался в соответствии с возрастом, был привит по календарю. Болел респираторными инфекциями. В возрасте 1 года 8 мес. 13.05.12 проглотил кристаллы химического средства «Крот», предназначенного для чистки засоров водосточных труб в быту. В тот же день ребенок поступил в отделение интенсивной терапии районной больницы по месту жительства, где находился одни сутки и был переведен детскую больницу областного уровня. Проводилась инфузионная детоксикационная и симптоматическая терапия.
Результаты фиброгастродуоденоскопии (ФГДС) от 25.05.12: пищевод свободно проходим, просвет несколько сужен в средней трети, эластичность стенки снижена, слизистая отечна, изъязвленная, контактно кровоточит. Определяются множественные грануляции на всем протяжении, Z-линия нечеткая. Нижний пищеводный сфинктер сомкнут. Желудок воздухом расправляется, просвет нормальный, стенка эластичная, перистальтика нормальная во всех отделах. Привратник симметричный, округлый, проходим. Заключение: химический ожог пищевода II-III степени, желудка — I степени. От дальнейшего лечения мать отказалась и 26.05.12 с ребенком ушла из больницы.
Спустя две недели ребенок повторно госпитализирован в ту же больницу. При ФГДС от 07.06.12 выявлено: пищевод непроходим для эндоскопа 5 мм, просвет сужается на расстоянии 12 см от зубов. Стенки ригидные, слизистая белесоватая, тусклая, ранимая. Заключение: стеноз пищевода III степени. Состояние после химического ожога.
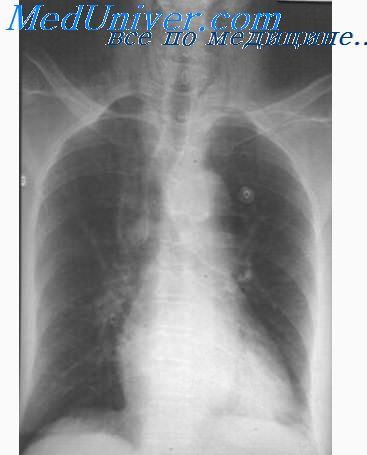
Для дальнейшего лечения ребенок переведен в Детский хирургический центр УЗ «Городская клиническая больница № 1» Минска. На рентгенограмме от 12.06.12 визуализируется сужение пищевода до 2 мм протяженностью 10 мм на уровне Тh2 и до 4-5 мм на уровне Тh2-Тh4 с выраженным супрастенотическим расширением (рис. 1).
Рис. 1. Пациентка Д. Рентгенограмма. Контрастирование пищевода. Стеноз пищевода на уровне Th2-Th4 и супрастенотическое расширение. При ФГДС 14.06.12 выявлено сужение просвета пищевода, диаметр которого составляет около 1 мм за счет послеожогового рубца (рис. 2). Рис. 2. Пациентка Д. Эзофагоскопия. До начала дилатации. Выполнена баллонная дилатация области сужения с применением дилататоров № 12 и 18 FR по 5 мин, протяженность стриктуры составила 3,0 см. Повторно 18.06.12 выполнена баллонная дилатация пищевода дилататором № 21 FR в течение 5 мин, после которой просвет пищевода увеличился до 4,6 мм (рис. 3). Рис. 3. Пациентка Д. Эзофагоскопия. После баллонной дилатации.
20.06.12 произведена первая операция лазерной реканализации рубцовой стриктуры пищевода с применением неодимового излучателя длиной волны 1064 нм мощностью 20 Вт.
С улучшением состояния ребенок был выписан домой, даны рекомендации о симптоматическом медикаментозном лечении и плановой госпитализации через 5 дней. В последующем за период с июня 2012 г. до декабря 2014 г. ребенок был госпитализирован 55 раз с интервалом 2-3 нед. За это время проведено 43 хирургических и диагностических вмешательства с чередованием лазерной реканализации и методов механической дилатации стриктуры пищевода, которые продолжались до июня 2016 г.
13.06.16 рентгенологически визуализируется в проекции Th2-Th5 участок сужения пищевода протяженностью 60 мм, расправляемый контрастом до 6 мм. 15.06.16 при ФГДС и спектральной хромоскопии в области сужения просвета пищевода видны наложения фибрина, признаки метаплазии и гиперплазии слизистой оболочки. Ребенку выполнена баллонная дилатация (№ 39 FR, 5 мин) и установлен пищеводный стент. 16.06.16 и 18.06.16 при контрольном рентгенологическом исследовании подтверждено правильное расположение пищеводного стента в проекции Th3-Th20 (рис. 4).
Рис. 4. Пациентка Д. Рентгенограмма. Пищеводный стент. После проведения баллонной дилатации 21.09.16 ребенок пожаловался на боли за грудиной, кашель. Объективное исследование выявило аускультативно проводные хрипы, на обзорной рентгенограмме органов грудной клетки — подкожная эмфизема, пневмоторакс слева, пневмомедиастинум. Назначены инфузионная, антибактериальная терапия, ингаляции, в течение 5 сут ребенок лечился в анестезиолого-реанимационном отделении, на 15-е сутки выписан домой.
12.10.16 неодимовым излучателем выполнены лазерная реканализация стриктуры (1064 нм, 20 Вт) и лазерная вапоризация очагов метаплазии слизистой оболочки (1340 нм, 15 Вт), после чего принято решение о необходимости реконструктивной операции на пищеводе. 15.11.16 выполнена субтотальная резекция пищевода с одномоментной эзофагоколонопластикой (рис. 5).
Рис. 5. Пациентка Д. Макропрепарат, удаленный пищевод. Послеоперационный период протекал без осложнений, ребенок выписан домой.
Химические ожоги пищевода дети получают в быту при проглатывании агрессивных химических веществ, содержащих щелочь или кислоту и используемых в домашних условиях. Способ открывания промышленных оригинальных флаконов с химическими веществами, как правило, имеет защиту от детей. Однако упаковки средств бытовой химии, имеющие нарядный вид, и вещества, окрашенные в яркий цвет, с привлекательным запахом, попадая в поле зрения ребенка, становятся предметом игры. Химические ожоги пищевода получают дети в возрасте от 1 года до 3 лет, когда зачастую еще питаются жидкой пищей из бутылки. Ребенок раннего возраста не понимает опасности и привычно пьет из бутылки ставшую доступной для него ядовитую жидкость. Подобные события происходят при недостаточном внимании взрослых, отсутствии настороженности, хранении химикатов в доступных для детей местах [1].
В ряде случаев исходом рубцовых послеожоговых стриктур пищевода у детей становятся утрата здоровья, инвалидизация в результате некорригируемых деформаций или перенесенной операции с утратой органа. Во многом исход предопределяется своевременностью первых неотложных мероприятий по детоксикации, проведенным курсом противовоспалительного лечения для купирования эзофагита, введением глюкокортикоидов, применением митомицина С [2-4]. Последующее дифференцированное ведение пациента зависит от состояния стенки пищевода, т. е. сохранности функции органа, и протяженности стриктуры. При повреждении стенки пищевода в пределах слизистого слоя на незначительном участке удовлетворительные результаты лечения дают эндоскопические методы дилатации с применением баллона или бужа [5]. Для ликвидации избыточного роста грануляций и метаплазии, которые не только уменьшают просвет пищевода, но и становятся фоном для малигнизации, применяют цитостатик (митомицин С), методы деструкции. В нашей клинике используется лазерная реканализация с применением неодимового излучателя с длиной волны 1064 нм, а при гипергрануляциях и метаплазии — лазерная вапоризация. Одним из этапов лечения протяженных стриктур можно использовать установку рассасывающегося пищеводного стента, способного моделировать просвет пищевода [6]. При тяжелых ожогах с необратимой утратой функции пищевода или неэффективностью предпринятых методов лечения следует своевременно выполнить реконструктивную хирургическую операцию [7]. Выполнение подобных операций при тяжелых химических ожогах пищевода сопряжено с техническими проблемами из-за рубцово-спаечного процесса в окружающих пищевод тканях вследствие воспаления стенки пищевода, послеоперационными осложнениями.
Следствием химического ожога пищевода у детей являются тяжелые деформации и стриктуры ротовой полости, глотки, пищевода, желудка. Полученная травма нуждается в сложном длительном лечении, многократном применении инвазивных методов с анестезиологическим обеспечением в условиях стационара. Наряду с физическим недугом, особым режимом приема пищи заболевание сопровождается психологической травмой как у ребенка, так и у взрослых родственников, несущих груз ответственности за утрату его здоровья. Избежать подобных драматических событий возможно путем информирования населения о тяжести последствий недостаточного внимания к детям и небрежного хранения химических веществ. Тяжесть химического ожога верхних отделов пищеварительного тракта зависит от совокупности факторов: состава и концентрации химического вещества, агрегатного состояния, количества проглоченного вещества, своевременности и объема первой неотложной помощи, непрерывности последующего планового лечения.
Эффективность лечения пациента с послеожоговой стриктурой пищевода во многом определяется глубиной ожога и длиной суженного участка органа, поэтому лечебно-диагностическая стратегия должна включать оценку степени поражения стенки пищевода и протяженности стриктуры. Выбор метода лечения ребенка с послеожоговой стриктурой пищевода должен быть обоснованным, необходимо включать поэтапное использование щадящих методик, направленных на увеличение просвета пищевода и восстановление его функции, а при отсутствии перспектив излечения — своевременно ставить вопрос о реконструктивно-пластической операции.
Приведенный в статье клинический пример обосновывает лечебно-диагностическую стратегию при химическом ожоге пищевода у детей:
— своевременное начало и завершенный курс медикаментозной противовоспалительной терапии, направленной на предупреждение формирования рубцовой стриктуры;
— раннее начало дилатационной терапии с применением пищеводного баллона-дилататора или бужа;
— использование пищеводного стента;
— при неэффективной дилатационной терапии в течение нескольких месяцев выполнять реконструктивное хирургическое вмешательство, объем которого определяется индивидуально.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Воронецкий Александр Николаевич — к.м.н., доцент кафедры детской хирургии УО «Белорусский государственный медицинский университет»; https://orcid.org/0000-0001-7091-376X; : anvoron@mail.ru
- З.С. Смирнова, Л.М. Борисова, М.П. Киселева и др. Доклиническое изучение противоопухолевой активности производного индолокарбазола ЛХС-1208 // Российский биотерапевтический журнал. 2014. № 1. С. 129.
- М.П. Киселева, З.С. Шпрах, Л.М. Борисова и др. Доклиническое изучение противоопухолевой активности производного N-гликозида индолокарбазола ЛХС-1208. Сообщение II // Российский биотерапевтический журнал. 2015. № 3. С. 41-47.
- Sprengel, «Pragmatische Geschichte der Heilkunde».
- https://rusendo.ru/ru/archive/theses-ru/29-2014/detskaya-endoskopiya/119-lechebnaya-taktika-rubtsovykh-suzhenij-pishchevoda-posle-khimicheskikh-ozhogov-u-detej.html.
- https://meduniver.com/Medical/Xirurgia/1483.html.
- https://ppt-online.org/679570.
- https://www.mediasphera.ru/issues/endoskopicheskaya-khirurgiya/2018/3/1102572092018031033.
- Moustafine R. I., Bukhovets A. V., Sitenkov A. Y., Kemenova V. A., Rombaut P., Van den Mooter G. Eudragit® E PO as a complementary material for designing oral drug delivery systems with controlled release properties: comparative evaluation of new interpolyelectrolyte complexes with countercharged Eudragit® L 100 copolymers. Molecular Pharmaceutics. 2013; 10(7): 2630–2641. DOI: 10.1021/mp4000635.
- Pund A. U., Shandge R. S., Pote A. K. Current approaches on gastroretentive drug delivery systems. Journal of Drug Delivery and Therapeutics. 2020; 10(1): 139–146. DOI: 10.22270/jddt.v10i1.3803.
- Bangun H., Aulia F., Arianto A., Nainggolan M. Preparation of mucoadhesive gastroretentive drug delivery system of alginate beads containing turmeric extract and anti-gastric ulcer activity. Asian Journal of Pharmaceutical and Clinical Research. 2019; 12(1):316–320. DOI: 10.22159/ajpcr.2019.v12i1.29715.