Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 апреля 2020; проверки требуют 3 правки.
Субдуральная гематома (СДГ) или субдуральное кровоизлияние — тип гематомы, обычно ассоциированный с черепно-мозговой травмой. При СДГ кровь изливается между твёрдой и паутинной мозговыми оболочками, как правило, вследствие разрыва мостиковых вен, залегающих в субдуральном пространстве, что приводит к повышению внутричерепного давления с компрессией и возможным повреждением вещества головного мозга. Острые СДГ часто являются жизнеугрожающим состоянием. Хронические СДГ, при адекватной терапии, имеют лучший прогноз.
Классификация[править | править код]
Субдуральные гематомы разделяют на острые, подострые и хронические, в зависимости от скорости их формирования[1]. Острые СДГ травматического генеза представляют собой наиболее распространённую причину летальности от ЧМТ и имеют высокий уровень смертности в отсутствие своевременного лечения — хирургической декомпрессии[2].
Острые кровотечения часто обусловлены высокоскоростными травмами ускорения-замедления, тяжесть их коррелирует с размером гематомы. Наиболее тяжёлыми являются СДГ, сочетающиеся с ушибом мозга[3]. Венозное кровоизлияние при острых СДГ развивается значительно быстрее по сравнению с хроническими, однако эпидуральные гематомы, обусловленные артериальным кровоизлиянием, обычно развиваются ещё быстрее. Несмотря на это, показатели смертности от острых СДГ превышают смертность от эпидуральных гематом и диффузных повреждений мозга, так как травма ускорения-торможения, достаточная по силе для развития СДГ, влечет за собой и другие тяжёлые повреждения[4]. При тяжёлой черепно-мозговой травме у пациентов с повреждениями кортикальных вен или пиальной артерии уровень смертности при острых СДГ составляет 60 — 80 %[5].
Хроническая субдуральная гематома формируется на протяжении нескольких дней или недель в результате меньшей по силе травмы, при этом в 50 % случаев пациенты не могут указать на травму в анамнезе[6]. Хроническая СДГ может оставаться нераспознанной в течение месяцев или даже лет после травмы, до наступления клинических проявлений[7]. Кровотечение при хронических СДГ обычно медленное либо представлено несколькими эпизодами незначительных кровоподтёков, и обычно останавливается самопроизвольно[8][9]. Небольшие хронические СДГ толщиной до 1 см имеют значительно лучший прогноз, чем острые СДГ; так, в одном из исследований указывалось, что лишь 22 % пациентов при таких хронических гематомах имели худший исход, чем «хорошее» или «полное восстановление»[3]. Хронические СДГ распространены в пожилом возрасте.[7].
Отличия от эпидуральных гематом[править | править код]
Клинические проявления[править | править код]
Клиническое манифестирование субдуральной гематомы имеет более медленное начало, чем при эпидуральной гематоме, в связи с меньшей скоростью венозного кровотечения по сравнению с артериальным. Классического для эпидуральной гематомы чётко ограниченного «светлого промежутка» может не наблюдаться, сроки манифестации симптомов крайне различаются — как непосредственно после травмы, в течение нескольких минут[11], так и отсроченно, через две недели[12]. Помимо этого, в отличие от классического «светлого промежутка», изменение состояния сознания при СДГ чаще волнообразно и постепенно[13].
При объёме кровоизлияния, достаточном для компрессии мозга, появляются признаки внутричерепной гипертензии или очаговая неврологическая симптоматика, обусловленная повреждением мозгового вещества[3] Клиническая картина СДГ крайне вариабельна. Помимо объёма гематомы, её локализации и др., имеет значение механизм травмы ускорения-торможения с противоударом, что нередко влечёт за собой двустороннее повреждение головного мозга[13].
Нарушение сознания при СДГ, в противоположность проявлениям эпидуральной гематомы, чаще развивается не по стволовому, а по кортикальному типу, и может иметь аментивные, онейроидные проявления, возможно развитие «лобной» симптоматики со снижением критики, нелепостью поведения и т. д.. Характерно психомоторное возбуждение, типична волнообразная головная боль с менингеальным оттенком или гипертензионного характера, усиление головной боли сопровождается рвотой. Встречаются эпилептические припадки, чаще генерализованные. В половине случаев наблюдается брадикардия. Отмечаются застойные явления на глазном дне, при хронической СДГ — с элементами атрофии соска зрительного нерва. Сочетание СДГ с тяжёлым ушибом мозга может сопровождаться такими стволовыми нарушениями, как расстройства дыхания и гемодинамики, диффузные изменений мышечного тонуса и рефлекторной сферы[13].
Этиопатогенез[править | править код]
Субдуральные гематомы, обусловленные травмой, носят название «травматических». Субдуральные гематомы значительно чаще, чем эпидуральные, обусловлены импульсными, диффузными травмами ускорения-торможения в силу приложения различных по направленности ротационных или линейных сил[3][8], при этом встряска внутричерепных структур способствует растяжению и повреждению мелких мостиковых вен[6]. Субдуральное кровоизлияние является классической находкой при синдроме детского сотрясения, для которого также характерно развитие интра- и преретинальных кровоизлияний, вызванных этим же механизмом воздействия. Помимо этого, субдуральные гематомы типичны у пожилых лиц и алкоголиков с признаками атрофии мозга. Атрофия мозга сопряжена с удлинением мостиковых вен, что повышает вероятность разрыва последних при импульсной травме. Также образованию субдуральной гематомы может способствовать снижение ликворного, и, соответственно, субарахноидального давления, что приводит к расхождению твёрдой и арахноидальной мозговых оболочек, натяжению и разрыву мостиковых вен. СДГ чаще наблюдается у пациентов, принимающих антикоагулянты и антиагреганты (варфарин, аспирин).
Факторы риска[править | править код]
Детский и пожилой возраст повышают вероятность развития СДГ. По мере возрастного уменьшения объёма мозга, субдуральное пространство расширяется, мостиковые вены становятся более длинными и подвижными. Этот фактор, в совокупности с хрупкостью стенок сосудов у пожилых людей, делает их более подверженными СДГ[6] . У маленьких детей субдуральное пространство также шире, чем у молодых взрослых, что повышает вероятность развития у них СДГ[3]; этим обусловлено типичное формирование СДГ при синдроме детского сотрясения. У молодых лиц фактором риска СДГ является наличие арахноидальных кист[14].
В числе других факторов риска — приём антикоагулянтов, алкоголизм и деменция.
Патофизиология[править | править код]
Скопление крови в субдуральной гематоме может осмотически притягивать дополнительную воду, что приводит к увеличению объёма гематомы, компрессии головного мозга и может провоцировать повторные кровоизлияния из-за разрыва новых кровеносных сосудов[6] . Кровь в СДГ также может формировать собственную капсулу[15].
В некоторых случаях возможны разрывы паутинной оболочки, таким образом в расширении интракраниального пространства и повышении внутричерепного давления участвует не только кровь, но и ликвор[8].
Из СДГ могут высвобождаться вещества-вазоконстрикторы, снижающие кровоток, что обуславливает дальнейшую ишемию вещества мозга под субдуральной гематомой[9]. При снижении мозговой перфузии, запускается ишемический биохимический каскад, приводящий к гибели клеток мозга.
Кровяной сгусток постепенно реабсорбируется и замещается грануляционной тканью.
Диагностика[править | править код]
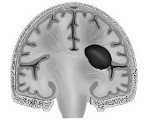
КТ-скан, демонстрирующий субдуральную гематому.
При любой травме головы необходимо получение медицинской помощи, включающей полное неврологическое обследование. В диагностике субдуральных гематом используются методы компьютерной и магнитно-резонансной томографии.
Наиболее часто субдуральные гематомы наблюдаются вокруг верхних и боковых поверхностей лобных и теменных долей головного мозга[3][8]. Также СДГ могут встречаться в задней черепной ямке, по ходу серпа мозга и намёта мозжечка[3]. В отличие от эпидуральных гематом, ограниченных швами черепа, субдуральные гематомы могут широко распространяться в полости черепа вдоль поверхности головного мозга, повторяя её форму и останавливаясь лишь в области отростков твёрдой мозговой оболочки.
При компьютерной томографии субдуральные гематомы имеют классическую серповидную форму, однако, могут выглядеть и линзовидно, особенно в начале кровотечения; это может вызвать затруднения в дифференциальной диагностике субдуральной и эпидуральной гематом. Более достоверным признаком субдуральной гематомы является её относительно большая распространённость по ходу полушария головного мозга с преодолением швов черепа, в отличие от эпидуральной гематомы. Субдуральная гематома также может выглядеть как «наслоение» повышенной плотности по ходу намёта мозжечка; такая гематома может быть хронической и стабильной, и косвенными минимальными признаками кровоизлияния могут служить сглаженность прилегающих борозд и медиальное смещение границы между серым и белым веществом.
Хронические гематомы при компьютерной томографии могут не дифференцироваться из-за своей изоденсивности мозговому веществу (иметь плотность вещества мозга), что затрудняет их выявление.
Лечение[править | править код]
Лечение субдуральной гематомы зависит от её размера и степени увеличения в динамике, возраста пациента, анестезиологического риска. Некоторые небольшие субдуральные гематомы могут подвергаться самостоятельной резорбции под тщательным динамическим наблюдением. Другие небольшие СДГ подлежат дренированию через тонкий катетер, проведённый через трепанационное отверстие в кости черепа. При больших или манифестированных гематомах проводится краниотомия, вскрытие твердой мозговой оболочки, удаление кровяного сгустка, выявление и контроль за местами кровотечения[16][17]. Послеоперационно возможно развитие внутричерепной гипертензии, отёка мозга, нового или повторного кровоизлияния, инфекционного процесса и судорожного синдрома. В редких случаях, при отсутствии шансов на восстановление или у пациентов старческого возраста, применяется паллиативная терапия[18].
При хронической субдуральной гематоме без судорожного синдрома в анамнезе, не существует однозначного мнения о целесообразности или вреде применения антиконвульсантов[19].
Примечания[править | править код]
- ↑ Herbert H Engelhard III, MD, PhD, FACS, Grant P Sinson, MD, George Timothy Reiter, MD, Paul L Penar, MD, FACS, Francisco Talavera, PharmD, PhD, Allen R Wyler, MD, Paolo Zamboni, MD, Allen R Wyler 2009. Subdural Hematoma Surgery . Medscape Reference, eMedicine.medscape.com retrieved on 7/21/2011.
- ↑ UCLA Neurosurgery [1] Архивная копия от 26 сентября 2015 на Wayback Machine retrieved on 7/21/2011.
- ↑ 1 2 3 4 5 6 7 Wagner AL. 2004. «Subdural hematoma.» Emedicine.com. Retrieved on August 8, 2007.
- ↑ Vinas F.C. and Pilitsis J. 2006. Penetrating Trauma. Emedicine.com.
- ↑ Dawodu S. 2004. «Traumatic brain injury: Definition, epidemiology, pathophysiology» Emedicine.com. Retrieved on August 7, 2007.
- ↑ 1 2 3 4 Downie A. 2001. «Tutorial: CT in trauma» Архивировано 6 ноября 2005 года.. Retrieved on August 7, 2007.
- ↑ 1 2 Kushner D. Mild Traumatic Brain Injury: Toward Understanding Manifeions and Treatment (англ.) // JAMA Internal Medicine (англ.)русск. : journal. — 1998. — Vol. 158, no. 15. — P. 1617-1624. — doi:10.1001/archinte.158.15.1617. — PMID 9701095.
- ↑ 1 2 3 4 University of Vermont College of Medicine. «Neuropathology: Trauma to the CNS.» Accessed through web on August 8, 2007.
- ↑ 1 2 Graham DI and Gennareli TA. Chapter 5, «Pathology of brain damage after injury» Cooper P and Golfinos G. 2000. Injury, 4th Ed. Morgan Hill, New York.
- ↑ Архивированная копия (недоступная ссылка). Дата обращения: 2 ноября 2014. Архивировано 4 марта 2016 года.
- ↑ Subdural hematoma : MedlinePlus Medical Encyclopedia. Nlm.nih.gov (28 июня 2012). Дата обращения: 27 июля 2012.
- ↑ Sanders MJ and McKenna K. 2001. Mosby’s Paramedic Textbook, 2nd revised Ed. Chapter 22, « and facial trauma.» Mosby.
- ↑ 1 2 3 Л.Б.Лихтерман, Институт нейрохирургии имени академика Н. Н. Бурденко. Травматические субдуральные гематомы. // Справочник поликлинического врача. — 2013. — № 11.
- ↑ Mori K., Yamamoto T., Horinaka N., Maeda M. Arachnoid cyst is a risk factor for chronic subdural hematoma in juveniles: twelve cases of chronic subdural hematoma associated with arachnoid cyst (англ.) // Journal of Neurotrauma (англ.)русск. : journal. — 2002. — Vol. 19, no. 9. — P. 1017-1027. — doi:10.1089/089771502760341938. — PMID 12482115.
- ↑ McCaffrey P. 2001. «The neuroscience on the web series: CMSD 336 neuropathologies of language and cognition.» Архивная копия от 6 апреля 2007 на Wayback Machine California e University, Chico. Retrieved on August 7, 2007.
- ↑ Koivisto T., Jääskeläinen J.E. Chronic subdural haematoma-to drain or not to drain? (англ.) // The Lancet : journal. — Elsevier, 2009. — Vol. 374, no. 9695. — P. 1040-1041. — doi:10.1016/S0140-6736(09)61682-2.
- ↑ Santarius T., Kirkpatrick P.J., Dharmendra G., et al. Use of drains versus no drains after burr-hole evacuation of chronic subdural haematoma: a randomised controlled trial (англ.) // The Lancet : journal. — Elsevier, 2009. — Vol. 374, no. 9695. — P. 1067-1073. — doi:10.1016/S0140-6736(09)61115-6.
- ↑ de Araújo Silva, DO; Matis G.K., Costa L.F., Kitamura M.A., de Carvalho Junior E.V., Silva Md, Barbosa B.A., Pereira C.U., da Silva J.C., Birbilis T.A., de Azevedo Filho H.R. Chronic subdural hematomas and the elderly: Surgical results from a series of 125 cases: Old «horses» are not to be shot!. (англ.) // Surgical Neurology International (англ.)русск. : journal. — 2013. — 25 March (vol. 3, no. 1). — P. 150. — doi:10.4103/2152-7806.104744. (недоступная ссылка)
- ↑ Ratilal, BO; Pappamikail, L; Costa, J; Sampaio, C. Anticonvulsants for preventing seizures in patients with chronic subdural haematoma. (англ.) // The Cochrane database of systematic reviews : journal. — 2013. — 6 June (vol. 6). — P. CD004893. — doi:10.1002/14651858.CD004893.pub3. — PMID 23744552.
20. Сайт о заболеваниях нервной системы. nervivporyadke.ru
Офтальмоскопические изменения в отдаленные сроки после черепно-мозговой травмы
Смирнова А.Ф., Кардаш А.М., Голубов К.Э., Котлубей Г.В.
Высокий процент инвалидности после перенесённой черепно-мозговой травмы (ЧМТ), многообразие клинических проявлений в различных возрастных периодах определяет медико-социальную значимость этой проблемы.
Особые трудности вызывает диагностика отдалённых последствий ЧМТ. Это связано с тем, что фоновые состояния больных, которые переносят ЧМТ, различны. В отдалённом периоде состояния маскируются другими, вновь развившимися заболеваниями, процессами биологического старения. Сама травма может способствовать развитию ряда заболеваний или вызывать обострение имеющихся.
Среди последствий ЧМТ далеко не последнее место занимают офтальмологические изменения. Нет четких доказательств связи между локализацией травмы и изменениями на глазном дне. В литературе достаточно полно представлены данные об особенностях ЧМТ в остром периоде повреждения. Однако только лишь в единичных публикациях представлены сведения о состоянии органа зрения у лиц в отдаленные сроки после повреждении.
Цель
Изучение изменений на глазном дне в отдаленном периоде черепно-мозговой травмы.
Материал и методы
Нами обследовано 1050 больных различного возраста, перенесших ЧМТ, в возрасте от 3 до 95 лет (в среднем — 52,6±8,4 года). Детей было 195, лиц молодого возраста — 227, среднего возраста — 217, пожилого — 212, старческого — 199. Больных, перенёсших сотрясение головного мозга, — 381 человек, ушибы головного мозга различной тяжести — 438 больных, ушибы мозга с размозжением мозгового вещества — 108 и 123 пациента были с наличием внутричерепных гематом. Обследования проводились в сроки от 3 до 5 лет после перенесённой ЧМТ.
Результаты и обсуждение
Важную роль в развитии изменений на глазном дне играло преморбидное состояние больного и его возраст. В частности, у детей с их высокой реактивностью центральной нервной и сосудистой систем, повышенной проницаемостью, склонностью к отёку мозга, периваскулярному и перицеллюлярному отёку, лабильностью всех реакций, глобальным ответом на любой стресс, довольно быстро все процессы компенсировались и нормализовались. У пожилых же пациентов в результате резко сниженной реактивности нервной и сосудистой систем организма, ригидностью сосудов, с понижением проницаемости усиливалась ломкость сосудов, отмечалось появление экстравазатов.
У всех больных с сотрясением головного мозга преимущественно наблюдались изменения со стороны сосудов сетчатки, выражающиеся в остром периоде ЧМТ расширением вен, их полнокровием, неравномерностью калибра, отеком сетчатой оболочки по ходу сосудов и патологическими сосудистыми рефлексами. В детском возрасте изменения со стороны сосудов сетчатки, как правило, исчезали к 10-15-му дню с момента травмы, и в отдалённом периоде не наблюдалось никаких изменений на глазном дне. В пожилом и старческом возрасте реакция со стороны сосудов сетчатки обычно сочеталась с имеющимися склеротическими изменениями, поэтому возникали затруднения в определении степени выраженности ангиопатий и динамики изменений на глазном дне. Обычно имеющиеся изменения сосудов оставались стойкими, а отёк сетчатки был более длительным.
В остром периоде при ушибах головного мозга у 97 (22,1%) больных наблюдались кровоизлияния на глазном дне. Они располагались по ходу сосудов, преимущественно вен, по всему глазному дну. Интересен был тот факт, что кровоизлияния в сетчатую оболочку без изменений со стороны диска зрительного нерва (ДЗН) были отмечены преимущественно у больных, которые получали ЧМТ при падении с высоты либо при сдавлении и тяжелой травме грудной клетки. По характеру преобладали ретинальные и субретинальные кровоизлияния. Ретинальные кровоизлияния, при которых повреждались сосуды крупного и среднего калибра, располагались радиально вокруг диска зрительного нерва, имели линейную или штрихообразную форму; по ходу вен они были округлой, овальной формы либо точечные. Субретинальные кровоизлияния были отмечены у 37 больных и имели вид расплывчатого темно-красного пятна позади сосудов сетчатки. Рассасывались они очень медленно и сохранялись от 3 недель до 1,5 месяцев с момента травмы. В заднем полюсе сетчатки у 27 больных отмечался диффузный отек, обширные белые экссудативные очаги различной формы, которые перекрывали сосуды. Отек макулярной области различной степени выраженности подтверждён оптической когерентной томографией (ОКТ). Он достаточно медленно исчезал, и на этом месте через несколько месяцев развивались рубцовые изменения в сетчатке с участками пигментации.
Лечение детей с тяжелой ЧМТ было более эффективно, чем у взрослых, поскольку пластичность мозга и компенсаторные возможности организма ребенка способствовали более быстрому восстановлению утраченных функций. Кровоизлияния быстро и в отдаленном периоде бесследно рассасывались.
В отдаленном периоде у 48 больных среднего и пожилого возраста кровоизлияния рассосались бесследно, правда, у 4 пациентов было отмечено снижение зрения. У 35 больных в области кровоизлияний отложился пигмент. Двое больных отметили, что после ЧМТ резко снизилось зрение в сумерках, при осмотре на глазном дне была типичная картина пигментной дегенерации с отложением пигмента в виде «костных телец» и «восковидной» атрофией зрительных нервов (ЗН).
Изменение со стороны диска зрительного нерва (ДЗН) в виде его отека отмечены у 137 больных с внутричерепными гематомами и у 19 — с тяжелыми ушибами головного мозга, сопровождающимися размозжением мозгового вещества. При ЧМТ отек ДЗН развивался на 2-4-е сутки, что свидетельствовало о нарастающем отеке мозга. При внутричерепных гематомах отек ДЗН в 103 случаях был начальной стадии выраженности и односторонним, причем в 89 случаях — на стороне гематомы, а у 34 больных он был двусторонним, но более выраженным на стороне гематомы. Однако это была промежуточная стадия развития процесса, и через 2-3 дня отек ЗН уже четко был двухсторонним. По степени выраженности отек ЗН у 99 больных был начальный, у 38 — выраженный, у 14 — сочетался с кровоизлияниями.
При исследовании больных спустя 3-5 лет после травмы, у 64 больных отек ДЗН прошел бесследно, у 19 — диск ЗН был деколорирован с височной половины, при этом острота зрения оставалась в пределах 1,0, а поле зрения на белый цвет и цвета было нормальное. Мы расценили подобные изменения со стороны ДЗН, как «постотечные». Эти больные в специальном лечении не нуждаются, т.к. это состояние, на наш взгляд, не является патологией.
У 17 больных, перенесших ушиб мозга с его размозжением, в отдаленном периоде констатировали побледнение ДЗН, что сопровождалось грубыми изменениями со стороны полей зрения по типу стойкой гомонимной гемианопсии различной степени выраженности и указывало на развитие нисходящей атрофии ЗН. Отек ДЗН в 2 раза чаще наблюдался в детском возрасте, тогда как у больных пожилого и старческого возраста при самых тяжелых ушибах головного мозга отек ДЗН был находкой.
Наиболее стойкими и демонстративными были изменения со стороны глазного дна у больных (21), перенесших краниорбитальные переломы, а также переломы основания черепа, когда трещины проходили через область турецкого седла или оптические отверстия. Двое больных, у которых трещина шла через оптические отверстия, в остром периоде ЧМТ жаловались на отсутствие зрения. При осмотре отмечены широкие зрачки с отсутствием реакции на свет, на глазном дне патологии не было диагностировано. Через год картина со стороны остроты зрения оставалась прежней, но на глазном дне — развитие нисходящей атрофии ЗН. У 19 больных при многооскольчатом краниоорбитальном переломе осколками и гематомами произошло сдавление ЗН, причем острота зрения в остром периоде была от светоощущения до 0,09. После оперативного вмешательства, которое сопровождалось декомпрессией ЗН, удалением гематом и детрита она поднялась от 0,07 до 0,8. Полученная острота зрения зависела от целостности ЗН и срока оперативного вмешательства. На глазном дне через 1-1,5 месяца появлялась картина частичной атрофии ЗН. Острота зрения, как правило, стабилизировалась в течение 10 месяцев. У 5 больных через год развился посттравматический оптико-хиазмальный арахноидит.
У 48 больных с трещинами и переломами основания черепа, повреждениями лобных пазух, назальной ликвореей в остром периоде ЧМТ на глазном дне не было изменений. Однако через 1,5-8 месяцев в зависимости от тяжести ЧМТ, больные стали замечать снижение зрения, а на глазном дне появилось побледнение дисков ЗН. По изменениям глазного дна в какой-то степени можно судить о давности процесса, уровне поражения базального отдела зрительного пути. Как правило, эти изменения связаны с рубцово-спаечным процессом и развитием травматического оптико-хиазмального арахноидита. Заслуживает особого внимания тот факт, что в молодом возрасте в отдаленном периоде данного вида ЧМТ у 24% больных на глазном дне констатировались остаточные явления перенесенной травмы в виде наличия пигментных и белых дегенеративных очагов в области кровоизлияний, отека сетчатки, частичной атрофии ЗН, изменения калибра и хода сосудов, при нормальном ликворном давлении и сохраняющейся неврологической симптоматике.
Выводы
Проведенный анализ картины глазного дна у больных в отдаленном периоде черепно-мозговой травмы показал, что она во многом зависит от тяжести и характера повреждения, а также возраста больного. В комплексной оценке остаточных явлений черепно-мозговой травмы исследование глазного дна имеет важное значение, так как даже при отсутствии каких-либо неврологических симптомов возможны изменения, позволяющие трактовать тяжесть острого периода и ее исходы.
- Wunderlich, «Geschichte der Medicin» (Штуттгардт, 1958).
- ОФС.1.2.1.2.0003.15 Тонкослойная хроматография // Государственная фармакопея, XIII изд.
- Харенко Е. А., Ларионова Н. И., Демина Н. Б. Мукоадгезивные лекарственные формы. Химико-фармацевтический журнал. 2009; 43(4): 21–29. DOI: 10.30906/0023-1134-2009-43-4-21-29.
- https://ru.wikipedia.org/wiki/%D0%A1%D1%83%D0%B1%D0%B4%D1%83%D1%80%D0%B0%D0%BB%D1%8C%D0%BD%D0%B0%D1%8F_%D0%B3%D0%B5%D0%BC%D0%B0%D1%82%D0%BE%D0%BC%D0%B0.
- https://eyepress.ru/article.aspx?24404.
- ОФС.1.2.1.2.0003.15 Тонкослойная хроматография // Государственная фармакопея, XIII изд.
- Харенко Е. А., Ларионова Н. И., Демина Н. Б. Мукоадгезивные лекарственные формы. Химико-фармацевтический журнал. 2009; 43(4): 21–29. DOI: 10.30906/0023-1134-2009-43-4-21-29.
- Debjit B., Rishab B., Darsh G., Parshuram R., Sampath K. P. K. Gastroretentive drug delivery systems- a novel approaches of control drug delivery systems. Research Journal of Science and Technology;10(2): 145–156. DOI: 10.5958/2349-2988.2018.00022.0.
- З.С. Смирнова, Л.М. Борисова, М.П. Киселева и др. Доклиническое изучение противоопухолевой активности производного индолокарбазола ЛХС-1208 // Российский биотерапевтический журнал. 2014. № 1. С. 129.