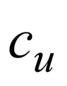Коллоидная химия
Силы межмолекулярного взаимодействия.
Когда вещество находится в газообразном состоянии, тогда образующие его частицы — молекулы или атомы — хаотически движутся и при этом преобладающую часть времени находятся на больших расстояниях (в сравнении с их собственными размерами) расстояниях друг от друга. Вследствии этого силы взаимодействия между ними пренебрежимо малы.
Иначе обстоит дело, когда вещество находится в конденсированном состоянии — в жидком или твёрдом. Здесь расстояния между частицами вещества малы и силы взаимодействия между ними велики. Эти силы удерживают частицы жидкости или твёрдого тела друг около друга. Поэтому вещества в конденсированном состоянии имеют, в отличии от газов, постоянный при данной температуре объём.
Все силы, удерживающие частицы жидкости или твёрдого тела друг около друга, имеют электрическую природу. Но в зависимости от того, что представляют собой частицы — являются ли они атомами металического или неметалического элемента, ионами или молекулами — эти силы существенно различны.
Неметалы с атомным строением
Если вещество состоит из атомов, но не является металлом, то его атомы обычно связаны друг с другом ковалентной связью.
Металлы
Если вещество — металл, то часть электронов его атомов становится общими для всех атомов. Эти электроны свободно движутся между атомами, связывая их друг с другом.
Вещества с ионным строением
Если вещество имеет ионное строение, то образующие его ионы удерживаются друг около друга силами электростатического притяжения.
Вещества с молекулярным строением
В веществах с молекулярным строением имеет место межмолекулярное взаимодействие.
Силы межмолекулярного взаимодействия, называемые также силами Ван-дер-Ваальса, слабее ковалентных сил, но проявляются на больших расстояниях. В основе их лежит электростатическое взаимодействие диполей, но в различных веществах механизм возникновения диполей различен.
1. Ориентационное взаимодействие.
Если вещество состоит из полярных молекул, например, Н2О, НCl, то в конденсированном состоянии молекулы ориентируются друг по отношению к другу своими разноимённо заряженными концами, вследствии чего наблюдается их взаимное притяжение.
Такой вид межмолекулярного взаимодействия называется ориентационным взаимодействием. Тепловое движение молекул препятствует их взаимной ориентации, поэтому с ростом температуры ориентационный эффект ослабевает.
2. Индукционное взаимодействие.
В случае веществ, состоящих из неполярных, но способных к поляризации молекул, например СО2, наблюдается возникновение наведённых или индуцированных диполей.
Причина их появления обычно состоит в том, что каждый атом создаёт вблизи себя электрическое поле, оказывающее поляризующее действие на ближайший атом соседней молекулы. Молекула поляризуется и образовавшийся индуцированный диполь в свою очередь поляризует соседние молекулы.
В результате происходит взаимное притяжение молекул друг к другу. Это индукционное взаимодействие наблюдается также и у веществ с полярными молекулами, но при этом оно обычно значительно слабее ориентационного.
3. Дисперсионное взаимодействие.
Дисперсионные силы (Лондоновские силы) — силы электростатического притяжения мгновенного и индуцированного (наведённого) диполей электрически нейтральных атомов или молекул.
В атомах и молекулах электроны сложным образом движутся вокруг ядер. В среднем по времени дипольные моменты неполярных молекул оказываются равными нулю. Но в каждый момент электроны занимают какое-то положение. Поэтому мгновенное значение дипольного момента (например, у атома водорода) отлично от нуля. Мгновенный диполь создаёт электрическое поле, поляризующее соседние молекулы. В результате возникает взаимодействие мгновенных диполей.
Считается, что дисперсионная энергия не имеет классического аналога и определяется квантовомеханическими флуктуациями электронной плотности.
Как показывает квантовая механика, мгновенные диполи возникают в твёрдых телах и жидкостях согласованно, причём концы соседних молекул оказываются заряженными электричеством противоположного знака, что приводит к их притяжению.
Это явление, называемое дисперсионным взаимодействием, имеет место во всех веществах, находящихся в конденсированном состоянии. В частности, оно обуславливает переход благородных газов при низких температурах в жидкое состояние.
Соотношение молекулярных сил.
Относительная величина рассмотренных видов межмолекулярных сил зависит от полярности и от поляризуемости молекул вещества.
Чем больше полярность молекул, тем больше ориентационные силы.
Чем крупнее атомы, чем слабее связаны внешние электроны атомов, чем больше деформируется электронное облако, тем значительнее дисперсионные силы.
Таким образом, в ряду однотипных веществ дисперсионное взаимодействие возрастает с увеличением размеров атомов, составляющих размеры этих веществ.
Например:
- в случае HCl на долю дисперсионных сил приходится 81% всего межмолекулярного взаимодействия,
- для НBr эта величина составляет 95%,
- для HI — 99,5%.
Индукционные силы почти всегда малы.
Межмолекулярное взаимодействие
При межмолекулярном взаимодействии происходит взаимное влияние друг на друга соседних молекул или атомов. Эти частицы изначально должны быть нейтральными, т.е. электрически незаряженными.
Предположение о существование такого взаимодействия впервые высказал в 1873 году голландский ученый Я.Д. Ван-дер-Ваальс.
Изучая свойства газообразных веществ и жидкостей, он пришел к выводу, что есть особые силы, благодаря которым между молекулами возникает притяжение. Их существование через некоторое время было подтверждено, и они стали называться Ван-дер-Ваальсовыми силами (это одна из разновидностей межмолекулярного взаимодействия).
Силы, возникающие при межмолекулярном взаимодействии, подразделяются на две категории:
- силы притяжения;
- силы отталкивания.
Силы притяжения
Эти силы являются самыми значимыми для взаимодействия между частицами вещества. По своей природе они являются электростатическими. Силы притяжения, в свою очередь, подразделяются еще на две разновидности:
- Ван-дер-Ваальсовы силы: их действие распространяется сразу на всю молекулу;
- водородные связи: сфера их влияния ограничена отдельными участками.
Ван-дер-Ваальсовы силы
Эти силы по отношению к объему распространения их влияния являются близкодействующими. Их зона влияния распространяется на расстояние, не превышающее 0,3-0,5 нм.
Именно воздействием Ван-дер-Ваальсовых сил можно объяснить такие явления, как:
- сцепление в космическом пространстве между собой частиц, которые можно считать мелкими астероидами;
- кольца планет-гигантов, особенно планеты Сатурн (кольца Сатурна доступны для наблюдения с Земли даже в самый слабый телескоп);
- способность гекконов передвигаться по совершенно гладким поверхностям, таким как стекло.
Существует три их разновидности:
- дипольные (ориентационные) силы;
- индукционные (деформационные) силы;
- дисперсионные силы.
Дипольные силы можно наблюдать в полярных молекулах в процессе взаимодействия их диполей. Вокруг дипольной молекулы образуется электростатическое поле и происходит ориентация других диполей системы. Наибольшая сила притяжения между полярными молекулами отмечается в ситуации, когда их дипольные моменты расположены вдоль одной прямой. Возникновение такой силы обусловлено тем, что разноименные заряды отделены друг от друга несколько меньшим расстоянием, чем одноименные.
Значение энергии, высвобождающейся при подобном взаимодействии, находится в прямой зависимости от величины дипольных моментов и относительного положения диполей. Силой, противодействующей молекулярной ориентации, в данном случае является тепловое движение. Это значит, что энергия взаимодействия зависит в том числе и от температуры:
E o p = − 2 3 μ 1 2 μ 2 2 k T r 6 , E_{op} = — frac{2}{3} frac{mu^2_1 mu^2_2}{kTr^6}, Eop=−32kTr6μ12μ22,
где μ 1 mu_1 μ1 и μ 2 mu_2 μ2 — дипольные моменты молекул, которые участвуют во взаимодействии,
k k k — постоянная Больцмана (ее значение 1,38066·1023 Дж/К),
T T T — температура,
r r r — расстояние, которым разделены молекулы.
Индукционные силы возникают между двумя молекулами, одна из которых является полярной, а другая — неполярной. Вокруг полярной молекулы образуется электрическое поле. Оно способствует поляризации молекулы с электрическими зарядами. Положительные заряды движутся в сторону электрического поля, а отрицательные — в противоположном от него направлении.
Количество энергии при индукционном взаимодействии увеличивается вместе с возрастанием дипольного момента и стремительно сокращается при увеличении расстояний между частицами. С температурой индукционные силы никак не связаны.
E E Eинд = − 2 a 2 μ 1 2 r 6 , =- frac{2a_2 mu^2_1}{r^6}, =−r62a2μ12,
где α 2 α_2 α2 — значение степени поляризуемости неполярной молекулы.
Действие индукционных сил может наблюдаться также и между молекулами, обе из которых являются полярными.
Дисперсионные силы появляются вследствие движения электронов вокруг атомных ядер. Для правильного понимания их сущности атом можно представить в виде диполя, отрицательным полюсом которого является электрон, а положительным — протон. При этом наблюдается очень быстрое движение отрицательного полюса, т.е. электрона. В молекулах, расстояние между которыми небольшое, электроны движутся согласованно, и диполи оказываются расположенными по отношению друг к другу полюсами с противоположными значениями зарядов. Это приводит к тому, что они начинают притягиваться.
Природа дисперсионного взаимодействия была полностью раскрыта только после создания теории квантовой механики. С точки зрения этой теории получается, что в среднем по времени дипольные моменты у молекул, являющихся неполярными, имеют нулевое значение. Однако следует учитывать, что в любой момент времени каждый электрон занимает свое определенное положение. Из этого следует, что мгновенное значение дипольного момента не может быть равно нулю. Мгновенный диполь генерирует вокруг себя электрическое поле, вызывающее поляризацию расположенных по соседству молекул. Данные процессы приводят к взаимодействию мгновенных диполей.
Значение величины дисперсионного взаимодействия возрастает при ослаблении связи между электронами и ядром. Температура на ее значение влияния не оказывает.
E E Eдисп = − 3 2 1 r 6 I 1 I 2 I 1 + I 2 a 1 a 2 , = — frac{3}{2} frac{1}{r^6} frac{I_1 I_2}{I_1 + I_2} a_1a_2, =−23r61I1+I2I1I2a1a2,
где α 1 α_1 α1 и α 2 α_2 α2 — показатели поляризуемости молекул, находящихся в состоянии взаимодействия.
Данный вид взаимодействия получил название дисперсионного по той причине, что дисперсия света в веществе обусловлена такими же характеристиками молекул, как и в случае рассматриваемого процесса.
Возникновение дисперсионных сил не связано с наличием или отсутствием постоянных дипольных моментов, они возникают между всеми атомами или молекулами. Из всех трех разновидностей Ван-дер-Ваальсовых сил они считаются самыми мощными, их величина в большинстве случаев превосходит величину дипольных и индукционных сил. Например, в процессе взаимодействия молекул таких соединений, как CO или HBr, дисперсионные силы больше всех прочих в несколько десятков или даже сотен раз.
Исключение составляют лишь молекулы веществ с большими значениями дипольных моментов. Так, у молекул воды дипольные силы превосходят дисперсионные примерно в 3 раза.
Водородная связь
Особой формой межмолекулярных взаимодействий считается так называемая водородная связь. Как следует из названия, она возникает между молекулами, в составе которых содержатся атомы водорода. Она может формироваться в ситуации, при которой атом водорода соединен ковалентной связью с другим атомом, обладающим значительной электроотрицательностью, вследствие чего формируется частичный положительный заряд на атоме водорода. Такая связь образуется между двумя молекулами, при этом одна из молекул должна содержать частично положительно заряженный атом водорода, а другая — атом элемента с частичным отрицательным зарядом, который содержит неподеленную пару электронов.
Рассмотрим характерные особенности водородной связи на примере молекулы воды. В ней связи O-H характеризуются сильной степенью полярности. Атом водорода обладает частичным положительным зарядом, а атом кислорода — частичным отрицательным. Отметим также, что у атома кислорода имеются 2 неподеленные электронные пары. В результате молекула H2O образует 4 водородные связи с находящимися рядом молекулами этого же вещества. Каждая молекула в 2 водородных связях является донором пары атомов водорода с частичным положительным зарядом, а в оставшихся 2 — донором 2 неподеленных пар электронов атома кислорода. В результате образуется сетчатая структура, которая может быть представлена в 3 измерениях.
Именно наличием водородной связи обусловлена межмолекулярная ассоциация таких соединений, как фторид водорода, аммиак, спирты, карбоновые кислоты.
Если учитывать степень электроотрицательности элементов, не составит труда понять, что формирование самых сильных водородных связей будет происходить с участием атомов фтора. Для атомов кислорода их сила меньше, далее, у атомов азота она становится еще меньше. Возникновение водородных связей возможно также и внутри молекулы, если в ней содержатся протонодонорные и протоноакцепторные группы.
По прочности водородные силы превосходят Ван-дер-Ваальсовы. Однако энергия их все же не настолько велика, чтобы связь между частицами оставалась стабильной. Без особых изменений параметров среды межмолекулярная связь может не только легко разрушаться, но и без труда восстанавливаться. Это играет огромную роль для жизни всех известных живых организмов. Большинство протекающих в них биохимических процессов основано на формировании или разрушении водородной связи.
Силы отталкивания
Силы отталкивания начинают действовать, когда межмолекулярное расстояние сокращается до предельно возможного минимума. При таком сближении начинают соприкасаться внешние уровни электронов двух атомов. Как следует из принципа Паули, являющегося одним из базовых положений квантовой механики, заполненные электронные оболочки не могут проникать одна внутрь другой. Величина таких сил в значительной степени зависит от особенностей строения молекулы определенного вещества.
Тест по теме «Межмолекулярное взаимодействие»
Межмолекулярное взаимодействие
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 6 мая 2020; проверки требуют 3 правки.
Межмолекулярное взаимодействие — взаимодействие между молекулами и/или атомами, не приводящее к образованию ковалентных (химических) связей.
Межмолекулярное взаимодействие имеет электростатическую природу. Предположение о его существовании было впервые использовано Я. Д. Ван-дер-Ваальсом в 1873 году для объяснения свойств реальных газов и жидкостей. В наиболее широком смысле под ним можно понимать такие взаимодействия между любыми частицами (молекулами, атомами, ионами), при которых не происходит образования химических, то есть ионных, ковалентных или металлических связей. Иными словами, эти взаимодействия существенно слабее ковалентных и не приводят к существенной перестройке электронного строения взаимодействующих частиц.
На больших расстояниях преобладают силы притяжения, которые могут иметь ориентационную, поляризационную (индукционную) и дисперсионную природу (см. подробнее в статьях Силы Ван-дер-Ваальса и Дисперсионные силы). При усреднении по вращению частиц, происходящему вследствие теплового движения, потенциал межмолекулярных сил обратно пропорционален шестой степени расстояния, а ион-дипольных (как с постоянным, так и с наведенным диполем) — четвёртой степени. На малых расстояниях начинают преобладать силы отталкивания электронных оболочек частиц. Особым случаем является водородная связь — возникающее на малом расстоянии взаимодействие между атомом водорода одной молекулы и электроотрицательным атомом другой, когда эти атомы несут достаточно большой эффективный заряд.
Упаковку частиц и расстояние между ними в конденсированной фазе, определяющиеся равновесием между притяжением и отталкиванием, можно предсказать, исходя из ван-дер-ваальсовых радиусов составляющих молекулы атомов (ионных в случае ионов): расстояния между атомами разных молекул не должны превышать суммы радиусов этих атомов. Для моделирования межмолекулярных взаимодействий используют эмпирические потенциалы, среди которых наиболее известны потенциалы Леннард-Джонса (отталкивание описывается двенадцатой степенью обратного расстояния, притяжение — шестой) и Бакингема (с более физически обоснованным экспоненциальным отталкиванием), из которых первый более удобен для расчетов. В конденсированной фазе, где мультипольное разложение для молекул плохо применимо из-за близости молекул друг к другу, может применяться метод атом-атомных потенциалов, основанный на тех же потенциалах, но уже для парных взаимодействий атомов и с добавкой кулоновских членов, описывающих взаимодействие их эффективных зарядов.
Межмолекулярное взаимодействие, водородная связь[править | править код]
Дипольная молекула создает вокруг себя электростатическое поле и ориентирует остальные диполи системы, что приводит к снижению энергии. Рассчитанная П.Кизомом средняя энергия ориентационного диполь-дипольного взаимодействия между полярными молекулами составляет:
(формула 1) где — дипольный момент молекулы; r — расстояние между центрами молекул; k — константа Больцмана; T — температура по Кельвину.
Множитель (kT) в знаменателе отражает влияние флуктуации на ориентацию диполей вследствие теплового движения, которое возрастает с увеличением температуры. Кроме ориентационного, следует учитывать индукционный эффект (), то есть взаимодействие диполя с приведенным диполем, который, соответственно с П.Дебаем, равен:
(формула 2)
Ориентационные и индукционные силы возникают между полярными молекулами и не могут объяснить межмолекулярное взаимодействие между неполярными. Учитывание так сказать слабой квадруполь-квадруполь взаимодействия не решает проблему, тем более, что молекула типа и атомы инертных газов не имеют вообще квадрупольного момента (отметим, что квадрупольный момент (без дипольного) имеют молекулы типа квадруполями можно считать двухатомные гомоядерные молекулы — и т.д.).
Природа межмолекулярных сил в неполярных системах была определена Ф.Лондоном с помощью квантовой механики. Можно сказать лишь, что учитывание корреляции во время движения атомных электронов приводит к снижению энергии. Если движение электронов в разных атомах скоррелировано, то это также способствует снижению энергии. Атомы с подвижными электронами можно считать диполями, которые осциллируют с некоторой частотой . При синхронном движении электронов мгновенные диполи ориентируются всегда так, что это приводит к снижению энергии:
(формула 3)
Заменив на , где — энергия ионизации молекулы (атома), получим:
(формула 4) Эту формулу можно получить более последовательно (не применяя модель осциллирующих диполей) на основе теории возмущений.
Дж.Слетер и Дж.Кирквуд для взаимодействия многоэлектронных атомов вывели следующую формулу:
(формула 5) где N — количество электронов на внешней оболочке; m — масса электрона; е — его заряд.
Формулы (3) и (5) совпадают при N=1, если вместо подставить его выражение: Из приведенных формул можно сделать вывод о том, что основная характеристика, которая определяет величину сил Лондона, — это поляризованность () атомов (молекул). В связи с тем, что поляризованность тесно связана с коэффициентом преломления света и характеризует способность вещества к рассеиванию энергии (дисперсии) света, силы Лондона часто называют дисперсионными ().
Поляризованность зависит от размера частички, поэтому прочность молекулярных решеток должна возрастать с увеличением размеров атомов и молекул, которые взаимодействуют. Эта закономерность хорошо иллюстрируется увеличением температур кипения (аналогические зависимости наблюдаются для теплот и температур плавления, сублимации, испарения и т.д., то есть для величин, которые зависят от прочности молекулярных связей) в группе инертных газов, в гомологическом ряду парафинов.
Атом Гелия настолько мал и дисперсионные силы при взаимодействии атомов Гелия такие слабые, что Гелий не может существовать в кристаллическом состоянии даже при обычном давлении и 0К. Причина этого — существование нулевой кинетической энергии, которая для гелия больше, чем энергия связи. Наличие кинетической энергии ядер в связанных атомах (при 0К) является следствием соотношения неопределенностей Гейзенберга.
Энергия связи для гелия кДж/моль, где m — масса атома Гелия.
Поэтому, и кристаллическое состояние не может реализоваться даже при 0К. Лишь при большом внешнем давлении гелий может перейти в кристаллическое состояние.
Все межмолекулярные взаимодействия (их часто объединяют общим названием — взаимодействие Ван дер Вальса) можно выразить в таком виде:
Ориентационное, индукционное и дисперсионное взаимодействия делают разный вклад в энергию связи. Для атомов и неполярных молекул и равны нулю и остается только дисперсионное взаимодействие. Вклад ориентационных и индукционных сил увеличивается с ростом дипольного момента молекул. В молекуле (1D-дебай= Кл * м) вносит 0,005%, а — 14,4%, — 4,2%; В — 3,3%, — 2,2%; — 14,4%, — 4,2%.
Благодаря приведенным формулам можно сделать вывод, что даже для очень полярных молекул дисперсионное взаимодействие делает огромный вклад.
См. также[править | править код]
- Силы Ван-дер-Ваальса
- Межатомное взаимодействие
Литература[править | править код]
- [www.xumuk.ru/encyklopedia/2477.html Межмолекулярные взаимодействия] // Химическая энциклопедия. Т. 3. — М.: Большая Российская энциклопедия, 1992. С. 12-15.
- Маррел Дж., Кеттл С., Теддер Дж. Химическая связь / Пер. с англ. С. В. Христенко. Под ред. И. В. Александрова. — М.: Мир, 1980.- 382 с.
- Бараш Ю. С. «Силы Ван-дер-Ваальса» М.: Наука, 1988. 344с.
- Каплан И. Г. «Введение в теорию межмолекулярных взаимодействий» М.: Наука, 1982. 312с.
- Каплан И. Г. Межмолекулярные взаимодействия. Физическая интерпретация, компьютерные расчеты и модельные потенциал М.: БИНОМ. Лаборатория знаний, 2012. — 400 с. ISBN 978-5-94774-939-7
- «Межмолекулярные взаимодействия; от двухатомных молекул до биополимеров» Пюльман Б. (ред) Пер. с англ., М.: Мир, 1981. — 592с.
- Израелашвили Дж. Межмолекулярные и поверхностные силы. М.: Научный мир, 2011. — 456 с. ISBN 978-5-91522-222-8
Ссылки[править | править код]
- Межмолекулярное взаимодействие в ФЭ
- [www.xumuk.ru/bse/1603.html Межмолекулярное взаимодействие] в БСЭ
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных доменов |
- ОФС.1.2.1.1.0003.15 Спектрофотометрия в ультрафиолетовой и видимой областях // Государственная фармакопея, XIII изд.
- Baas, «Geschichte d. Medicin».
- Ковнер, «Очерки истории M.».
- https://xn—-7sbb4aandjwsmn3a8g6b.xn--p1ai/views/alchemy/theory/chemistry/colloid-chemistry/forces_intermolecular_interaction.php.
- https://studwork.org/spravochnik/himiya/mejmolekulyarnoe-vzaimodeystvie.
- https://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D0%B6%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B5_%D0%B2%D0%B7%D0%B0%D0%B8%D0%BC%D0%BE%D0%B4%D0%B5%D0%B9%D1%81%D1%82%D0%B2%D0%B8%D0%B5.
- М.П. Киселева, З.С. Смирнова, Л.М. Борисова и др. Поиск новых противоопухолевых соединений среди производных N-гликозидов индоло[2,3-а] карбазолов // Российский онкологический журнал. 2015. № 1. С. 33-37.